بلاگ
استانداردهای مهم برای سردخانه — HACCP، GMP و فراتر از آن

در سردخانهها — چه برای مواد غذایی و چه برای دارو و واکسن — رعایت استانداردها فقط «کاغذبازی» نیست؛ این استانداردها تضمینکنندهٔ ایمنی محصول، رعایت قوانین و کاهش ریسک مالی/حقوقی کسبوکار هستند. در ادامه مهمترین استانداردها و الزامات (HACCP, GMP, GDP، ISO و دستورالعملهای سازمانهای بهداشتی) را بهصورت عملی، مرحلهبهمرحله و با نکات اجرایی برای پیادهسازی شرح دادهایم.
مروری سریع — کدام استانداردها را باید بشناسید و هر کدام برای چه مناسباند؟
- HACCP (Hazard Analysis and Critical Control Points): چارچوبی مبتنی بر تحلیل ریسک برای شناسایی نقاط بحرانی ایمنی (برای غذا و زنجیره سرد).
- GMP (Good Manufacturing Practice) / GSP (Good Storage Practice): مجموعه اصول کیفیتی برای تضمین سلامت، ایمنی و کیفیت محصولات دارویی و مکملها؛ شامل شرایط نگهداری و تاسیسات میشود.
- GDP (Good Distribution Practice): استانداردهای نگهداری و توزیع دارو و واکسن در طول زنجیرهٔ توزیع؛ اطمینان میدهد محصول تا زمان تحویل کیفیتش حفظ شود.
- ISO 22000 / FSSC / BRC (برای غذا): استانداردهای سیستم مدیریت ایمنی مواد غذایی که سردخانهها در زنجیرهٔ تأمین غذا باید رعایت کنند.
- دستورالعملهای سازمانهای بهداشتی (WHO / CDC / ملی): برای واکسنها و داروها دستورالعملهای دقیق دمایی، اعتبارسنجی و مانیتورینگ وجود دارد (مثلاً محدوده 2–8°C برای بیشتر واکسنها، و نیازمندیهای ULT برای برخی واکسنهای mRNA).

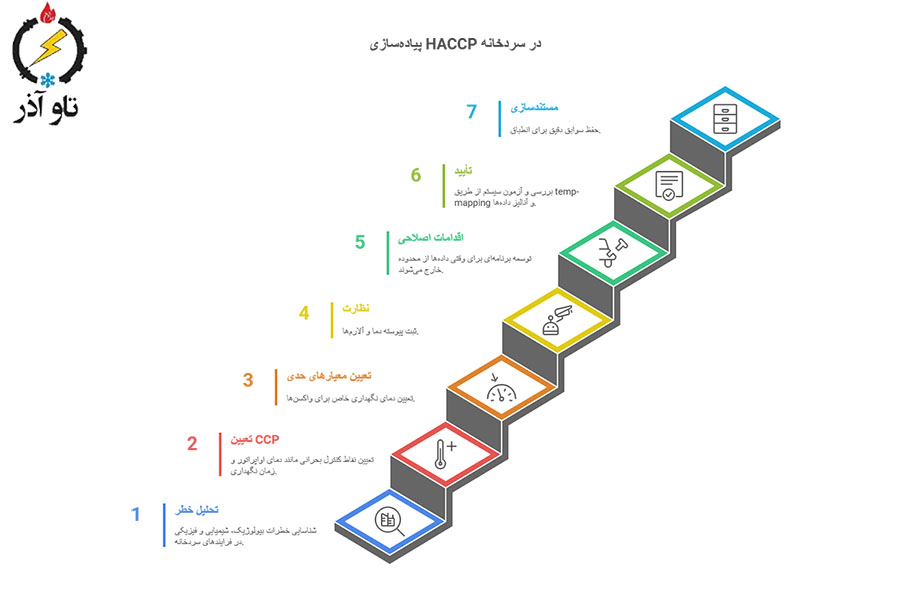
HACCP در سردخانه — چه چیزی باید پیاده شود؟
اصول و گامها (۷ اصل HACCP)
۱. تحلیل خطر (Hazard Analysis) — شناسایی خطرات بیولوژیک، شیمیایی و فیزیکی در فرایندهای سردخانه (دریافت، ذخیره، جابجایی).
۲. تعیین نقاط کنترل بحرانی (CCP) — مثال: دمای اواپراتور، زمان نگهداری، عملیات دیفراست.
۳. تعیین معیارهای حدی (Critical limits) — مثلاً دمای نگهداری +2 تا +8°C برای واکسنهای خاص.
۴. نظارت (Monitoring) — ثبت پیوسته دما، آلارمها و تستهای دورهای.
۵. اقدامات اصلاحی (Corrective actions) — برنامه مشخص برای وقتی دادهها از محدوده خارج شدند (نگهداری مجدد، قرنطینه، گزارش).
۶. تأیید (Verification) — بررسی و آزمون سیستم (مثل temp-mapping، آنالیز دادهها).
۷. مستندسازی و سوابق.
برای سردخانهها، HACCP باید بهصورت عملیاتی و با SOPهای دقیق برای هر مرحله (دریافت، استاکینگ، توزیع، دسترسی کارکنان) پیاده شود. منابع راهنمای HACCP برای سردخانهها راهنماییهای کاربردی در این زمینه دارند.
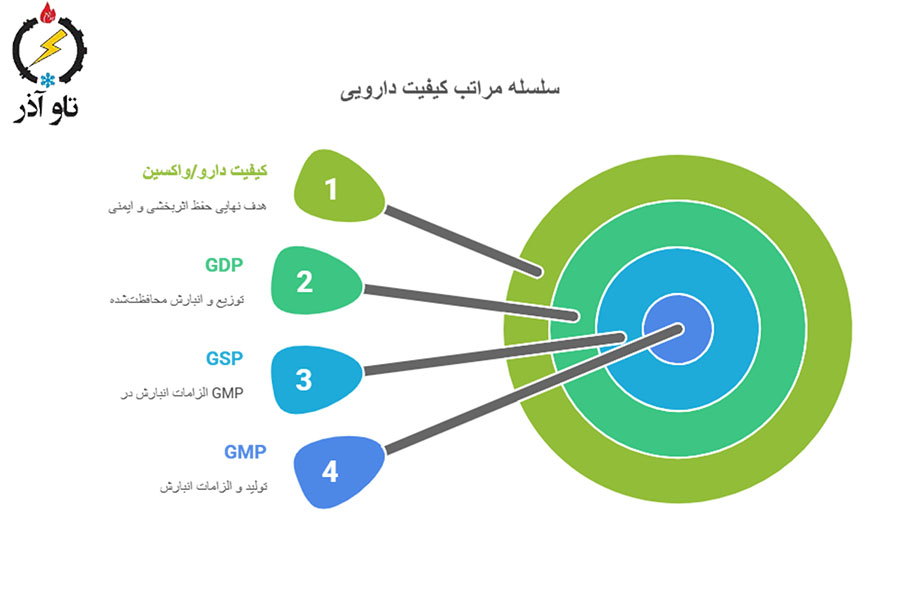
GMP / GSP برای محصولات دارویی و بیولوژیک — نکات ویژه سردخانه
تمایز GMP/GSP/GDP
- GMP عمدتاً روی تولید تمرکز دارد اما الزامات Storage (GSP) در GMP گنجانده میشود؛
- GDP بیشتر روی توزیع و انبارش محافظتشده از زمان خروج کارخانه تا تحویل نهایی تأکید دارد. هر سه در حفظ کیفیت دارو/واکسین نقش دارند.
الزامات کلیدی در سردخانهٔ مطابق GMP/GDP
- کنترل دما و رطوبت: دیتالاگرهای کالیبرهشده، آلارمهای لحظهای، ثبت پیوسته و نگهداری سوابق. (برای واکسنها اغلب +2–+8°C؛ برای برخی محصولات −20°C یا −80°C).
- ساختار و بهداشت محل: سطوح قابل شستوشو، جداسازی زونها (محصولات مشکوک/خراب، کارهای بارگیری)، کنترل آفات.
- امنیت و کنترل دسترسی: ثبت ورود/خروج، دسترسی محدود و دوربین.
- سندهای SOP برای هر فعالیت: پذیرش، کنترل کیفیت ورود، FIFO/FEFO، واکنش به excursions، مرجوعی.
- اعتبارسنجی (IQ/OQ/PQ): نصب (IQ)، عملکرد (OQ) و عملیات در شرایط واقعی (PQ) باید انجام و مستند شود.

GDP — وقتی محصول باید از انبار تا بیمار یا داروخانه ایمن بماند
الزامات عملی GDP
- شرایط حمل و نقل کنترلشده: وسایل نقلیه مجهز به ردیاب دما و ثبتکننده.
- پلن انتقال اضطراری: راهکارهای انتقال محصول (سردخانه پشتیبان یا فوراً جابهجایی) در صورت قطع برق یا نوسان دما.
- سلسلهمراتب مسئولیت و اسناد تحویل: chain of custody، امضای تحویل و ثبت دادههای حمل.
- بازرسی و تطبیق با مقررات محلی/اروپایی/ملی: توزیعکننده باید مطابق مقررات منطقهای (مثلاً EU GDP یا راهنمای WHO) عمل کند.

ISO 22000، BRC و استانداردهای مواد غذایی — برای سردخانههای غذایی
چه چیزی اضافه میشود؟
- سیستم مدیریت ایمنی غذایی (FSMS) با تمرکز بر HACCP، مدیریت ریسک، ردیابی (traceability) و رسیدگی به شکایات.
- الزام به آموزش مستمر کارکنان، مدیریت آلودگی متقاطع و برنامهٔ پاکسازی/ضدعفونی منظم.
موارد فنی حیاتی برای انطباق عملی (چکلیست اجرایی)
پایش و ثبت دما
- دیتالاگر کالیبرهشده با ثبت حداقل هر 5–15 دقیقه (بسته به محصول) و نگهداری لاگها حداقل مطابق مقررات ملی/شرکت/مشتری.
نقشهبرداری دما (Temperature mapping)
- اجرای temp-mapping در زمان راهاندازی و پس از تغییرات ساختاری یا تجهیزی؛ نشان میدهد کجای سردخانه hot/cold spot دارد و CCPها کجا هستند. (بخشی از OQ/PQ).
آلارم و پاسخگویی
- تعریف آستانههای هشدار و کریتیکال، نحوهٔ اطلاعرسانی (SMS/ایمیل/تلفن) و اقدامات اصلاحی استاندارد شده.
کالیبراسیون و نگهداری تجهیزات
- برنامهٔ کالیبراسیون سالانه برای دیتالاگرها و ترموستاتها. گزارش کالیبراسیون باید قابل استناد باشد.
SOPها و آموزش
- SOPهای مکتوب برای پذیرش، بارگیری، دسترسی کارکنان، نگهداری، واکنش به excursions و مدیریت مرجوعی باید وجود داشته و کارکنان آموزش دیده و مستندسازی شوند.
ثبت و ردیابی (Traceability)
- سیستم بارکد/لِیبلینگ و ثبت مکان دقیق پالت/محصول برای انجام Recall سریع در صورت نیاز. این الزامها در استانداردهای ISO/BRC و GDP برجستهاند.

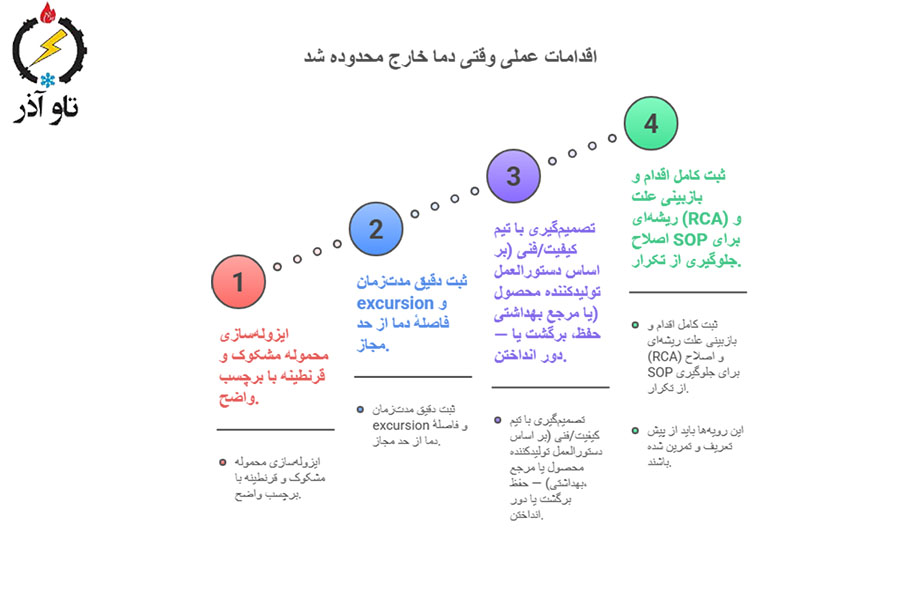
اقدامات عملی وقتی دما خارج محدوده شد (Corrective actions)
- ایزولهسازی محموله مشکوک و قرنطینه با برچسب واضح.
- ثبت دقیق مدتزمان excursion و فاصلهٔ دما از حد مجاز.
- تصمیمگیری با تیم کیفیت/فنی (بر اساس دستورالعمل تولیدکننده محصول یا مرجع بهداشتی) — حفظ، برگشت یا دور انداختن.
- ثبت کامل اقدام و بازبینی علت ریشهای (RCA) و اصلاح SOP برای جلوگیری از تکرار.
این رویهها باید از پیش تعریف و تمرین شده باشند.
اعتبارسنجی (IQ/OQ/PQ) — چه تستهایی لازم است؟
- IQ: بررسی اینکه تجهیزات طبق مشخصات نصب شدهاند (پنلها، یونیت، دیتالاگر، برق).
- OQ: تست عملکردی؛ دماها در نقاط مختلف در بازه زمانی مشخص پایدار بمانند؛ آلارمها کار کنند.
- PQ: تست با بار واقعی محصول (شبیهسازی شرایط عملیاتی: باز و بسته شدن درب، بارگیری واقعی) و ثبت نتایج.
راهاندازی برای محیطهای دارویی اغلب بدون IQ/OQ/PQ معتبر پذیرفته نمیشود.

نکات حقوقی و هماهنگی با نهادهای نظارتی
- هر کشور/منطقه ممکن است نسخهٔ محلی از GDP/GSP/GMP را اجرا کند؛ پیش از راهاندازی کسبوکار سردخانهٔ دارویی یا واکسینال باید الزامات محلی (ثبت، بازرسی) را بررسی کنید.
- برای واکسنها معمولاً سازمانهای ملی بهداشت/مرکز ایمونیزاسیون دستورالعملهای خاص دارند که باید رعایت شود.
جمعبندی مختصر — ۱۰ الزام کلیدی که حتماً رعایت شوند
- برنامه HACCP طراحی و مستند شده باشد.
- دیتالاگرهای کالیبرهشده با ثبت پیوسته نصب شده باشند
- IQ/OQ/PQ انجام و مستند شود (بهویژه برای دارو/واکسن).
- SOPهای پذیرش/انبار/توزیع/واکنش به excursions وجود داشته باشد.
- کنترل دسترسی و امنیت فیزیکی برقرار شود.
- برنامه کالیبراسیون و نگهداری پیشگیرانه تعریف شده باشد.
- سیستم آلارم و پاسخگویی از راه دور فعال باشد.
- قابلیت traceability و مدیریت recall وجود داشته باشد.
- آموزش مستمر کارکنان و مستندسازی دورهای انجام شود.
- انطباق با مقررات ملی/منطقهای (GMP/GDP) و مستندات WHO/CDC برای محصولات خاص.


